Содержание:
- 1 Основа основ Прежде чем говорить о слишком мощной и явно патологической воспалительной реакции, нужно понять, как вообще работает воспаление. Это сложная биологическая реакция на любое повреждение наших клеток или вторжение инфекционных агентов. Она неспецифическая, то есть воспалительный ответ будет и на солнечный ожог, и на ушиб, и на занозу, и на вирус. Но как тогда организм узнает, что пора реагировать? За ответ на этот вопрос шведские биохимики Суне Бергстрём и Бенгт Самуэльсон, а также британский фармаколог Джон Вейн в 1982 году получили Нобелевскую премию по физиологии или медицине. Арахидоновая кислота. С нее все начинается. Она присутствует в клеточной мембране и высвобождается, если клетка гибнет. Причина не важна: это может быть и следствие механического воздействия, и разрыв при выходе размножившихся в клетке вирусных частиц. Свободная арахидоновая кислота начинает окисляться, запускается знаменитый каскад, который сегодня знают все студенты-медики. При содействии ферментов-циклооксигеназ синтезируются тромбоксаны, лейкотриены и простагландины. Эффекты именно этих медиаторов воспаления проявляются в виде классической пятерки признаков: повышение температуры (причем не только локально, в месте повреждения, но и глобально, во всем организме), боль, покраснение, отек и нарушение функции клеток. Затем к воспалению подключаются клетки иммунной системы, между собой они «переговариваются» при помощи специальных сигнальных молекул — интерлейкинов. В итоге в водоворот событий оказываются вовлечены десятки молекул и клеток. Цель воспаления — не только устранить спровоцировавший его фактор, но и восстановить целостность клеток. Мало того, это процесс саморегулирующийся, в каскаде арахидоновой кислоты образуются как провоспалительные, так и противовоспалительные агенты. Все прекращается, когда устанавливается динамическое равновесие: поврежденные клетки зачищены, на их месте образовались новые, патогенов в организме нет, жизнь продолжается. Иногда воспаление может затягиваться и превращаться из блага в проблему. Что интересно, и недостаточно выраженное воспаление, и гиперреакция одинаково опасны для организма. В первом случае возбудитель будет чувствовать себя слишком вольготно, массово размножится и навредит человеку. Во втором — навредит уже иммунная система, «решившая» применить внутри собственного организма оружие массового поражения. Цитокиновый шторм — яркий пример второго сценария. Цитокиновый шторм (cytokine storm, cytokine release syndrome) представляет собой форму системной воспалительной реакции организма, характеризующейся массовым высвобождением цитокинов. Цитокины — низкомолекулярные белки, вырабатывающиеся преимущественно эффекторными клетками крови и осуществляющие регуляцию межклеточных и межсистемных взаимодействий. На сегодня известно несколько десятков цитокинов. По своему действию они делятся на провоспалительные, противовоспалительные, регуляторы клеточного и гуморального иммунитета. Развитие цитокинового шторма обусловлено неконтролируемой активацией иммунной системы и дисрегуляцией синтеза про- и противовоспалительных цитокинов и хемокинов. В результате такого чрезмерного высвобождения цитокинов и хемокинов развивается гипервоспалительный ответ. От его выраженности зависит как тяжесть течения, так и сам исход, и долгосрочные последствия перенесенного заболевания. Через годы, через века
- 2 Трудности стандартизации
- 3 Симптомы и проявления
- 4 Подходы к лечению
О цитокиновом шторме активно заговорили с началом пандемии Covid-19, ведь именно он повышает риск развития тяжелых осложнений и летальных исходов у многих пациентов с коронавирусной инфекцией. Однако само по себе это явление не новое и достаточно неоднозначное: оно показывает, как иммунная система вместо того, чтобы бороться со злом, примыкает к нему и помогает возбудителям болезни уничтожать макроорганизм, вверенный ей для охраны и обороны. Naked Science попробовал разобраться, что представляет собой цитокиновый шторм и какие способы его терапии существуют.
Основа основ
Прежде чем говорить о слишком мощной и явно патологической воспалительной реакции, нужно понять, как вообще работает воспаление. Это сложная биологическая реакция на любое повреждение наших клеток или вторжение инфекционных агентов. Она неспецифическая, то есть воспалительный ответ будет и на солнечный ожог, и на ушиб, и на занозу, и на вирус.
Но как тогда организм узнает, что пора реагировать? За ответ на этот вопрос шведские биохимики Суне Бергстрём и Бенгт Самуэльсон, а также британский фармаколог Джон Вейн в 1982 году получили Нобелевскую премию по физиологии или медицине.
Арахидоновая кислота. С нее все начинается. Она присутствует в клеточной мембране и высвобождается, если клетка гибнет. Причина не важна: это может быть и следствие механического воздействия, и разрыв при выходе размножившихся в клетке вирусных частиц.
Свободная арахидоновая кислота начинает окисляться, запускается знаменитый каскад, который сегодня знают все студенты-медики. При содействии ферментов-циклооксигеназ синтезируются тромбоксаны, лейкотриены и простагландины.
Эффекты именно этих медиаторов воспаления проявляются в виде классической пятерки признаков: повышение температуры (причем не только локально, в месте повреждения, но и глобально, во всем организме), боль, покраснение, отек и нарушение функции клеток. Затем к воспалению подключаются клетки иммунной системы, между собой они «переговариваются» при помощи специальных сигнальных молекул — интерлейкинов. В итоге в водоворот событий оказываются вовлечены десятки молекул и клеток.
Цель воспаления — не только устранить спровоцировавший его фактор, но и восстановить целостность клеток. Мало того, это процесс саморегулирующийся, в каскаде арахидоновой кислоты образуются как провоспалительные, так и противовоспалительные агенты.
Все прекращается, когда устанавливается динамическое равновесие: поврежденные клетки зачищены, на их месте образовались новые, патогенов в организме нет, жизнь продолжается.
Иногда воспаление может затягиваться и превращаться из блага в проблему. Что интересно, и недостаточно выраженное воспаление, и гиперреакция одинаково опасны для организма. В первом случае возбудитель будет чувствовать себя слишком вольготно, массово размножится и навредит человеку. Во втором — навредит уже иммунная система, «решившая» применить внутри собственного организма оружие массового поражения. Цитокиновый шторм — яркий пример второго сценария.
Цитокиновый шторм (cytokine storm, cytokine release syndrome) представляет собой форму системной воспалительной реакции организма, характеризующейся массовым высвобождением цитокинов.
Цитокины — низкомолекулярные белки, вырабатывающиеся преимущественно эффекторными клетками крови и осуществляющие регуляцию межклеточных и межсистемных взаимодействий.
На сегодня известно несколько десятков цитокинов. По своему действию они делятся на провоспалительные, противовоспалительные, регуляторы клеточного и гуморального иммунитета.
Развитие цитокинового шторма обусловлено неконтролируемой активацией иммунной системы и дисрегуляцией синтеза про- и противовоспалительных цитокинов и хемокинов.
В результате такого чрезмерного высвобождения цитокинов и хемокинов развивается гипервоспалительный ответ. От его выраженности зависит как тяжесть течения, так и сам исход, и долгосрочные последствия перенесенного заболевания.
Через годы, через века

Повышенный уровень цитокинов наблюдается при различных заболеваниях. Но в ряде случаев превышение их концентрации происходит в сотни и даже тысячи раз, что, в свою очередь, приводит к развитию тяжелых и жизнеугрожающих состояний.
К примеру, «цитокиновый шторм» может встречаться при таких заболеваниях и состояниях, как сепсис, рассеянный склероз, острый панкреатит, острый респираторный синдром, грипп, состояние после тяжелых травм, лихорадка Эбола и другие.
Не исключено, что именно патологический иммунный ответ стал причиной невероятно высокой смертности во время испанки — пандемии гриппа 1918-1919 годов. Реконструированный вирус H1N1, выделенный во время пандемии 1918-го, по сравнению с обычными эталонными штаммами вируса гриппа А, вызывал крайне выраженное воспаление легких у мышей.
Если заглянуть в историю, то можно обнаружить, что термин «цитокиновый шторм» встречался в медицинской литературе уже в 1993 году: Джеймс Феррара и соавторы употребили это словосочетание для описания реакции «трансплантат против хозяина» (РТПХ).
Трудности стандартизации
До сих пор нет четкого согласования ни для определения, ни для классификации цитокинового шторма. Связано это с тем, что, по данным российских и зарубежных авторов, при разных патологиях повышаются разные группы цитокинов.
Например, определение Национального института рака США, основанное на Общих терминологических критериях нежелательных явлений (CTCAE), слишком широкое, поскольку критерии воспалительного синдрома вполне применимы и для некоторых физиологических состояний. В то время как определение Американского общества трансплантологии и клеточной терапии основывается на критериях, которые сосредотачиваются исключительно на ятрогенных (вызванных медицинским вмешательством) причинах цитокинового шторма, и, по сути, игнорирует инфекционные причины.
К тому же грань между нормальным и патологическим ответами организма весьма условна. Одни и те же цитокины могут приносить как пользу для макроорганизма, так и вред. Плюс многие из них взаимосвязаны. Так что крайне сложно сказать, где заканчивается неравная битва с возбудителем и начинается смертоносная борьба.
Симптомы и проявления
Как и в случае с определением и пониманием причин, четкой и характерной клинической картины у цитокинового шторма нет, особенно на начальных стадиях.
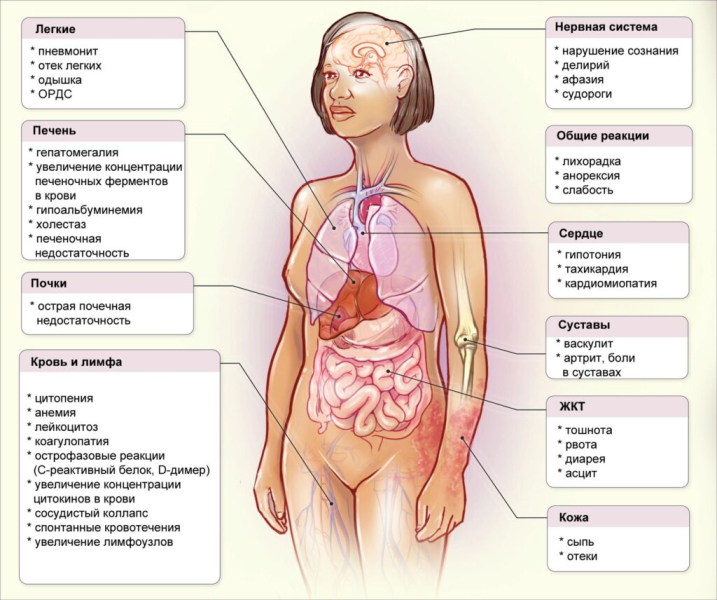
Симптомы могут быть вызваны как прямым повреждением клеток цитокинами, так и опосредованным — через иммунные клетки.
Следствием цитокинового шторма может стать развитие ряда серьезных патологических состояний. В их числе — острый респираторный дистресс-синдром, развитие нарушений свертывания крови, полиорганная недостаточность и прочее.
Так, например, SARS-CoV-2-индуцированный цитокиновый шторм активирует коагуляцию за счет стимуляции провоспалительными цитокинами (IL-6, IL-8), экспрессии тканевого тромбопластина и активации системы свертывания. Кроме того, происходят активация тромбоцитов и дисфункция клеток эндотелия.
Результатом таких изменений могут стать массивное тромбообразование и закупорка мелких и крупных сосудов различных органов, что вызывает нарушение циркуляции в этих органах и последующее нарушение их нормального функционирования.
Все это может привести к самому печальному исходу. Да и в случае разрешения болезни последствия могут быть крайне неблагоприятными.
Подходы к лечению
Общая стратегия заключается в борьбе с основным заболеванием, в поддержании функций организма и подавлении избыточной иммунной реакции. Конкретика зависит от причины возникновения цитокинового шторма и степени его тяжести. При этом важный нюанс — фокусное воздействие на цитокины, на которых замыкаются критически важные звенья патогенеза.
На сегодня накоплено немало исследований по медикаментозному лечению цитокинового шторма. Из лекарственных препаратов неплохо зарекомендовал себя тоцилизумаб — моноклональное антитело, антагонист рецептора интерлейкина-6 (IL-6R). При тяжелом течении возможна его комбинация с кортикостероидами — гормональными препаратами, мощно подавляющими системные воспалительные реакции.
В клинической практике успешно используют ингаляционный кортикостероид будесонид («Будостер», «Пульмикорт», «Респинид»), который угнетает высвобождение многих цитокинов непосредственно в дыхательных путях.
Существенный минус в том, что и у моноклональных антител, и глюкокортикостероидов есть ряд побочных эффектов. К ним относятся инфекции верхних дыхательных путей, нарушение функции печени, стероидный диабет, артериальная гипертензия и другие. К тому же, если говорить о некоторых моноклональных антителах, то только блокада растворимых и мембранных форм IL-6R не может выступать эффективным методом подавления цитокинового шторма, так как взаимодействие IL-6 на поверхности Т-клеток может происходить напрямую, без участия рецептора.
Заболевания, медицинские процедуры и методики лечения, которые могут осложниться цитокиновым штормом: • CAR-T — иммунотерапия опухолей крови, когда собственные Т-клетки человека оснащают искусственным, химерным рецептором, способным распознавать антигены на поверхности атипичных клеток. Среднетяжелый или тяжелый цитокиновый шторм регистрируется от четверти до половины случаев применения CAR-T, а легкий – практически у всех. Реже «штормит» пациентов, проходящих иммунотерапию по поводу неходжкинской лимфомы, хронического лимфоцитарного лейкоза и множественной миеломы. • Терапия биспецифическими антителами (например, блинатумомабом) — есть риск возникновения шторма при первом введении препарата. В исследовании 189 пациентов с рецидивирующим/рефрактерным острым лимфобластным лейкозом, которых лечили блинатумомабом, тяжелый шторм зарегистрировали лишь у 2% пациентов. • Гаплоидентичная аллогенная трансплантация гематопоэтических клеток. В группе из 75 пациентов, перенесших терапию с трансплантатами периферической крови, насыщенными Т-клетками, тяжелый шторм зарегистрировали у 12%, легкий — у 75%. • Другие виды иммунотерапии. О редких цитокиновых штормах сообщалось после применения антитимоцитарного глобулина, а также моноклональными антителами, включая ритуксимаб, обинутузумаб, брентуксимаб и некоторые другие. • Тяжелые инфекции. В наше время цитокиновый шторм описан для гриппа и для Covid-19.
Не стоит также забывать, что чем больше препаратов в составе терапии, тем выше риски развития как нежелательных явлений, так и межлекарственных взаимодействий. Поэтому предпочтение стараются отдавать монотерапии.
Но наука не стоит на месте: постоянно появляются инновационные разработки для упреждения развития гипервоспаления. Например, препарат «Атериксен», который снижает выработку провоспалительных цитокинов IL-6, IL-8 и хемокинов MIG (CXCL9) и IP-10 (CXCL10) — основных медиаторов острой фазы воспаления, лихорадки и цитокинового шторма.
Немаловажно, что этот препарат также снижает воспаление в легочной ткани и обеспечивает защитный иммунный ответ при заражении респираторными вирусами, что особенно актуально в свете Covid-индуцированного цитокинового шторма, с которым мы, к сожалению, так близко познакомились в последние несколько лет.
Учитывая, что при цитокиновом шторме организм страдает не только от основного заболевания, но и от ударов собственного иммунитета, немаловажное значение приобретают токсичность применяемых препаратов и их побочные эффекты. «Атериксен» обладает благоприятным профилем безопасности и переносимости, а иммунотоксических, мутагенных, канцерогенных или аллергизирующих свойств у него не обнаружено.
Продвижение исследований и лечения цитокинового шторма требует междисциплинарного подхода с привлечением всех достижений современной науки. Профилирование биомаркеров и конкретизация задействованных в каждом конкретном случае цитокинов позволят индивидуализировать лечение и увеличить шансы не только на выживание, но и на предупреждение тяжелых осложнений и последствий цитокинового шторма.
И это прекрасное далёко как раз не за горами: лаборатории готовы выдать в клиническую практику новые методики и препараты уже в ближайшее десятилетие.
Click here to preview your posts with PRO themes ››


